近日,关正辉教授团队在对烯烃羰基化活性催化剂的深入研究基础上,设计并实现了第一例金属杂六元环的Retro-Diels-Alder反应。研究成果以“C(alkyl)–C(vinyl) bond cleavage enabled by Retro-Pallada-Diels-Alder reaction”为题在线发表于Nature Communications(《自然-通讯》)。

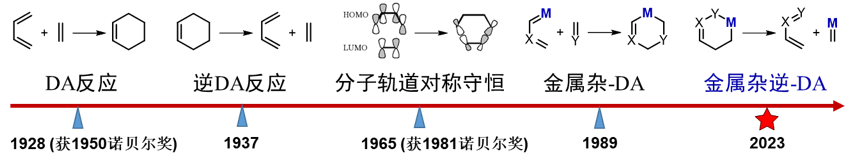
Diels-Alder(DA)反应及其逆反应(Retro-Diels-Alder)是重要和基础的碳碳键生成与裂解方法,对其研究伴随着现代化学的发展而不断深入:1928年Diels和Alder报道了之后以他们名字命名的Diels-Alder反应(获1950年诺贝尔化学奖),随后Woodward和Hoffmann等人以此为基础发展了可以解释反应性和选择性的Woodward–Hoffmann规则(获1981年诺贝尔化学奖),上世纪八九十年代出现的金属杂Diels-Alder反应更是拓展了传统研究的范围。
基于该类反应的可逆性以及过渡金属催化在现代有机合成中的重要性,设计研究金属杂Retro-Diels-Alder反应将有望为惰性碳碳键的催化裂解发展新的模式。然而,由于碳金属中间体丰富的反应性(如还原消除、β-氢消除、交叉偶联等),该方面的研究充满了挑战,迄今未被实现。
研究团队以β,γ-烯基酮为底物,以酰基肼为环化辅助剂,在钯催化下通过Retro-Pallada-Diels-Alder的反应过程,实现了羰基α位碳(烷基)-碳(烯基)σ键的高选择性裂解。其中四价钯中间体的生成和钯氢催化剂的循环是该反应的关键。
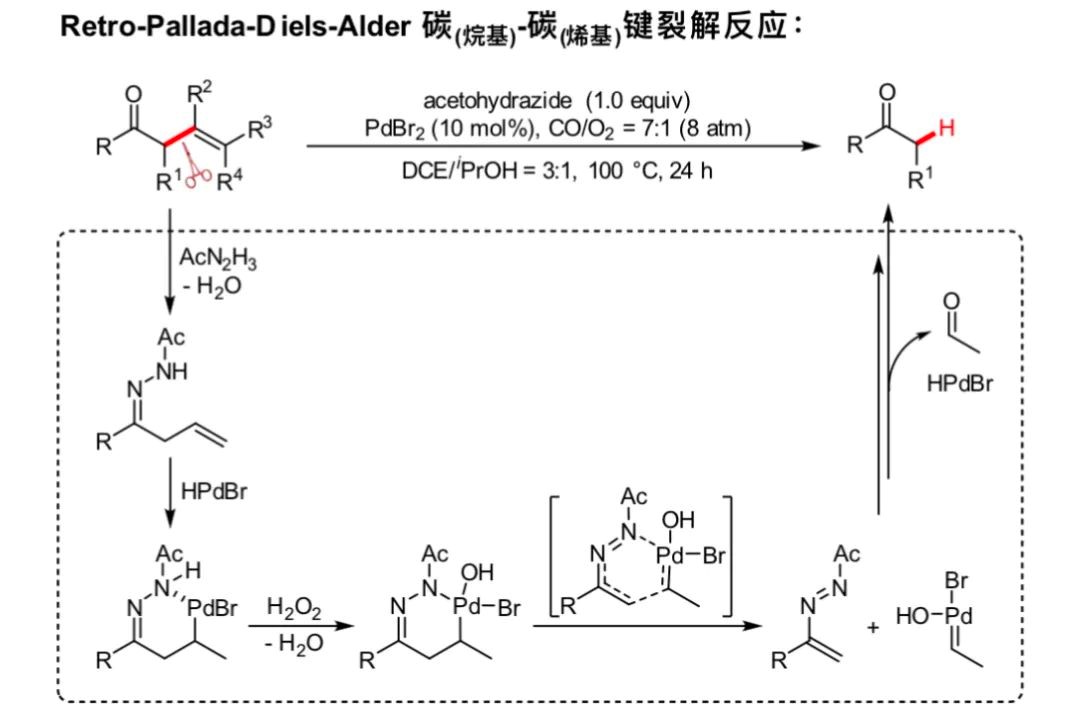
Retro-Pallada-Diels-Alder反应及机理
实验研究结合密度泛函理论计算表明,反应历经钯氢物种对烯基的插入、氧化环化产生四价钯环、Retro-Pallada-Diels-Alder开环裂解碳碳键等步骤;同时产生的烯基偶氮中间体在钯氢催化剂下通过还原水解等过程,最终获得烯基被裁剪的酮类产物。该研究也为惰性碳碳键的选择性裂解发展了全新的策略,有望应用于复杂有机分子的裁剪和编辑。