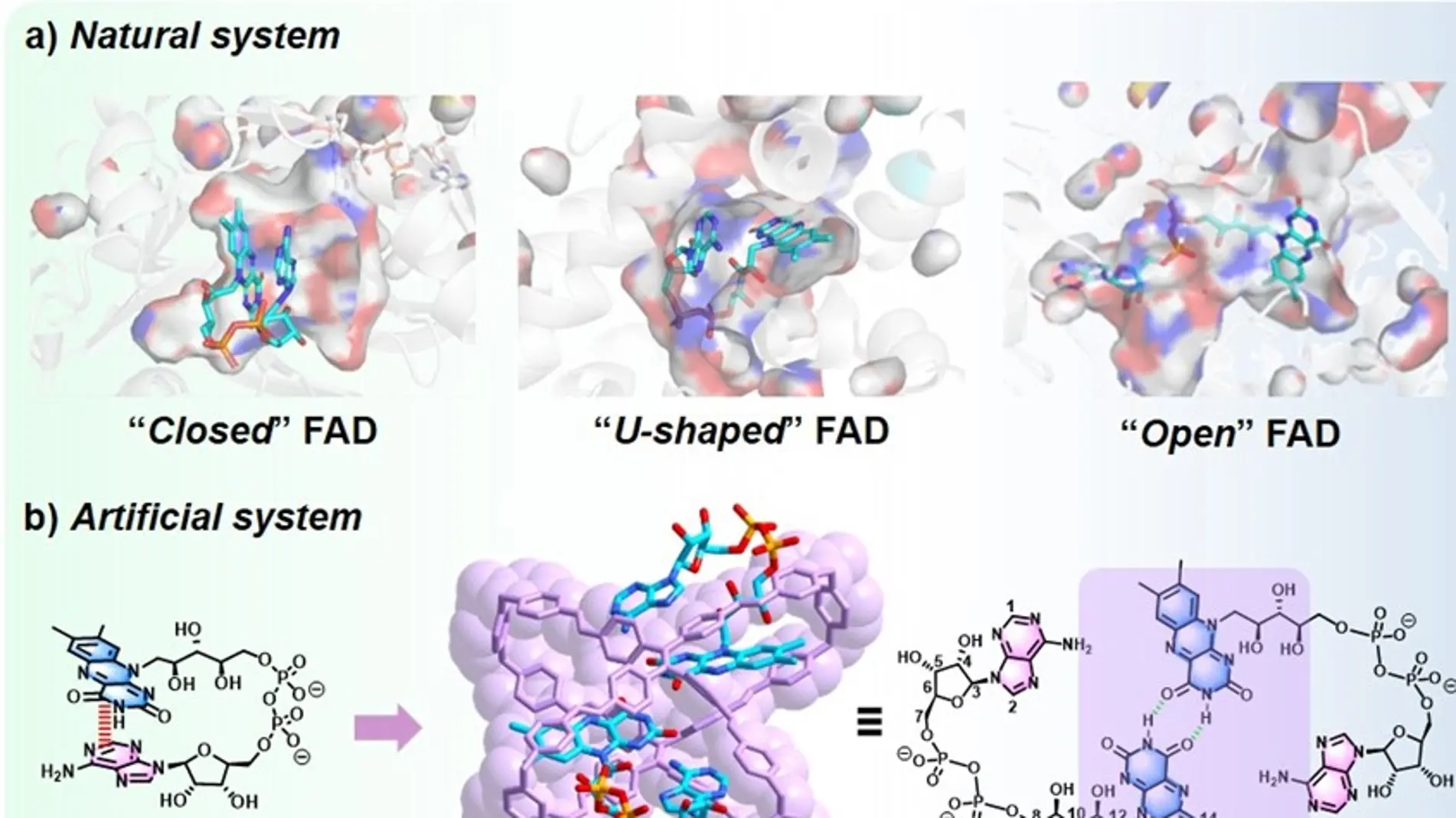
在生命系统中,蛋白酶因其识别和催化特性在生物化学合成中起着至关重要的作用,辅酶分子,如烟酰胺腺嘌呤二核苷酸(NADH)和黄素腺嘌呤二核苷酸(FAD),可以结合在酶的疏水空腔内形成酶-辅酶复合物,从而激活、调节或抑制蛋白酶的生理功能。
受大自然的启发,近日,曹利平教授团队在水溶性大环超分子人工体系对生物分子识别与手性响应机制的深入研究基础上(Angew. Chem. Int. Ed. 2023, 62, e202308029; Angew. Chem. Int. Ed. 2024, e202405150; Chem. Sci. 2024, 15, 3758-3766等),设计了一例仿生分子笼体系用于调控FAD构象实现NADH的高效氧化催化辅助的光动力治疗(图1)。研究成果以“Tetraphenylethene-Based Molecular Cage with Coenzyme FAD: Conformationally Isomeric Complexation toward Photocatalysis-Assisted Photodynamic Therapy”为题在线发表于J. Am. Chem. Soc.上,原文链接:https://doi.org/10.1021/jacs.4c09508。
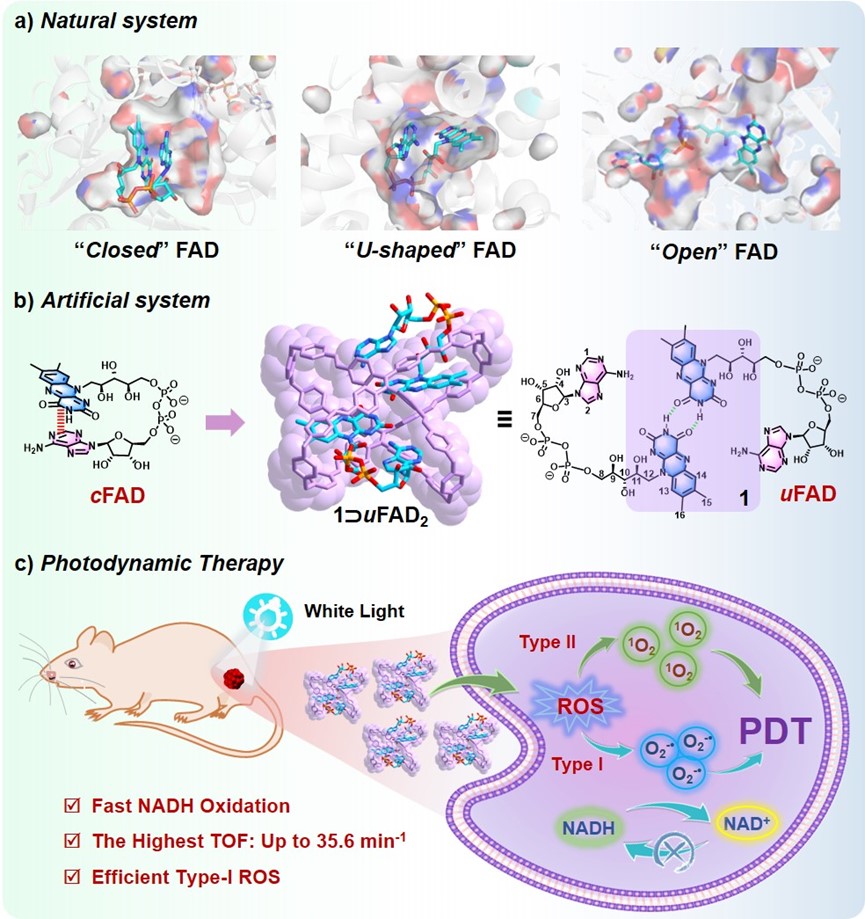
图1.人工酶-辅酶体系的设计理念及其PDT应用示意图
作者设计并合成了一种水溶性的四苯乙烯(TPE)基阳离子分子笼1作为新型的FAD人工宿主,通过主客体作用在水中实现对FAD构象异构体的可控络合。作者发现分子笼1能够结合两个FAD分子并在水中形成1:2的主客体复合物(1⸧uFAD2),在形成复合物的过程中,FAD发生构象异构化,从cFAD(自由态)转化为uFAD(络合态)。通过理论计算、圆二色性(CD)光谱等实验验证了复合物体系中的FAD的构象异构化(图2)。
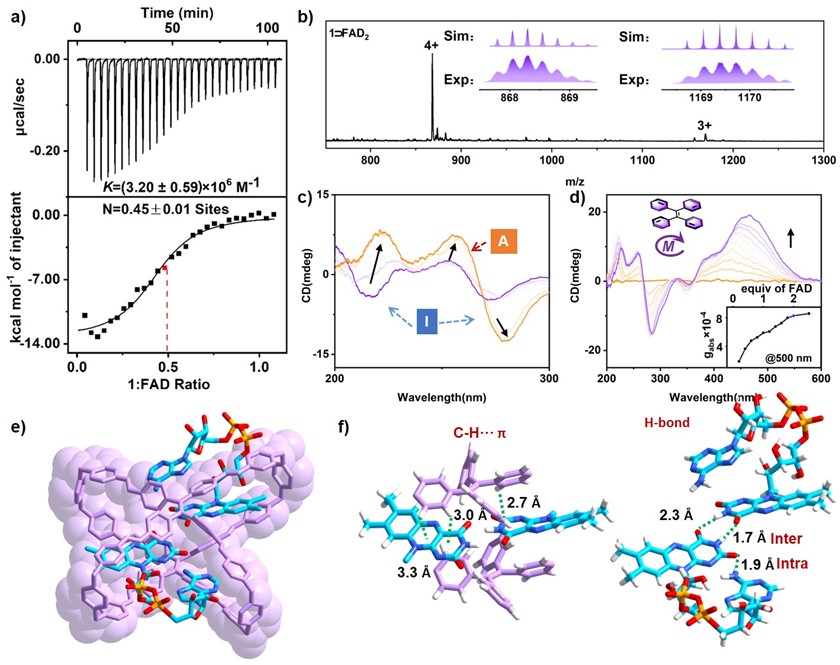
图2. 1⸧uFAD2的主客体结合及FAD的构象异构化
得益于1⸧uFAD2复合物之间有效的电子传递和能量传递,能够有效的促进活性氧(ROS)的产生,如超氧自由基(O2•−)和单线态氧(1O2)。使其在水中实现NADH的光催化氧化成为可能,其光催化氧化NADH的转化频率(TOF)值高达35.6 min-1,同时,可以通过破坏癌细胞内NADH及其氧化型NAD+之间的细胞内氧化还原平衡,从而导致癌细胞死亡。因此,1⸧uFAD2可以作为酶-辅酶型超分子光敏剂,在缺氧肿瘤中通过ROS的产生和NADH的氧化实现高效的光催化辅助PDT。
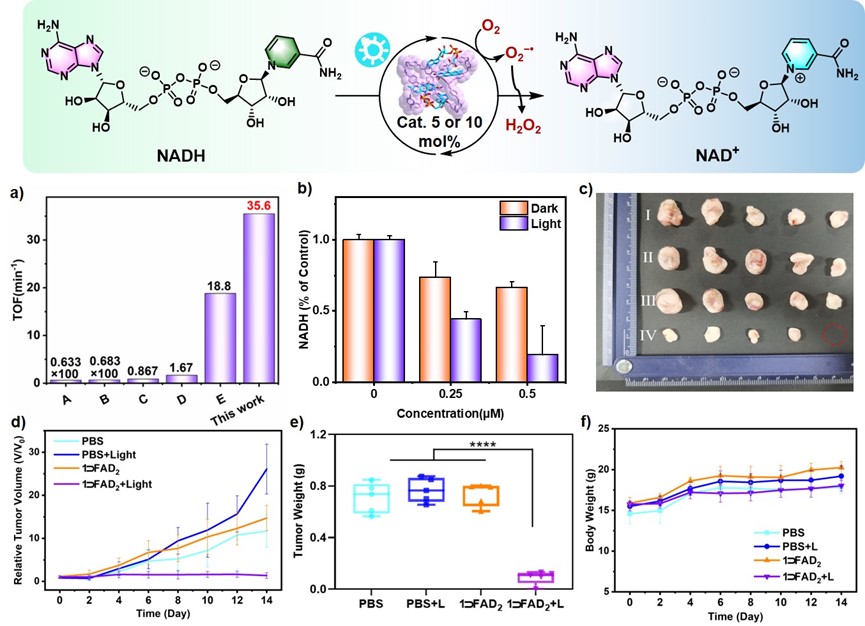
图3. 1⸧uFAD2催化氧化NADH及其PDT效果图
总结:在本篇工作中,曹利平教授课题组报道了一种基于TPE的人工仿酶分子笼,通过调节FAD的构象异构体来增强主客体复合物之间的能量传递和电子传递,从而实现了NADH的高效催化氧化,并将其应用于缺氧肿瘤的光催化辅助的PDT。为理解复杂生化过程的提供了一种新思路。