近日,我院王永强教授课题组利用铜催化的脱氢氧化串联策略,实现了间位羰基的苯酚和苯胺选择性合成。由于羰基处于有机合成的枢纽,通过其进一步转化,可以合成各种分子单元。本方法为间位取代酚类和苯胺提供了一种通用的合成路径。相关成果近期发表在Nature Communications(《自然-通讯》)上,题为“Synthesis of meta-carbonyl phenols and anilines”。

苯酚和苯胺是许多医药、农药、聚合物、染料和天然产物的核心骨架。目前,全球销量前100的药物中约25%是苯酚和苯胺类化合物及其衍生物,例如:左旋甲状腺素(Levothyroxine),平喘药沙丁胺醇(Albuterol),抗炎药双氯芬酸(Diclofenac)(图1a)。因此,如何高效地合成苯酚和苯胺一直是化学家们研究的热点。目前,合成苯酚的方法主要包括:(1)C(sp2)−H键的直接氧化;(2)过渡金属协助的C(sp2)−X键转化;(3)C(sp2)−M键的氧化。与苯酚相比,从相应的C(sp2)–H键合成苯胺往往需要经过多步或苛刻的反应条件,如,硝化、叠氮化等。在过去的一个多世纪中,三个伟大的人名反应:Ullmann−Goldberg反应,Buchwald−Hartwig反应和 Chan−Lam反应相继被开发用于生成C(sp2)-N键。这些方法已经成为基础研究和工业生成领域中制备苯胺的重要的方法。然而,这些方法往往需要使用预官能团化的芳烃,例如:卤代芳烃、类卤代芳烃、芳基硼化物等,其限制了这些方法的应用。近来,王永强课题组提出了一种从羰基取代的环己烷合成苯酚和苯胺的新策略。
苯酚和苯胺的取代基及取代的位置直接决定了其化学、物理性质。因此,在其苯环的特定位置引入化学官能团是一个非常关键的科学问题。传统上,芳香亲电取代反应是苯酚和苯胺引入取代基最有效的方法;由于羟基和氨基强的给电子能力及对应的邻、对位定位效应,通过芳香亲电取代反应原则上主要得到邻位和对位取代的产物,而间位取代的产物很难得到。为了冲破该邻对位定位限制,化学家们付出了巨大的努力。过去十几年,过渡金属催化的C-H键活化的策略得到了很好的发展。该策略利用钌催化的σ-键活化、远程模板导向、非共价相互作用、降冰片烯和羧酸无痕导向、立体位阻效应等,可以实现苯酚和苯胺间位C(sp2)–H键的官能团化。然而,这些策略往往需要多步操作,需要事先引入导向基,随后还需将其移除才能得到目标产物。此外,这些方法在得到间位官能团化的产物的同时,还会不可避免地产生一定量的邻位和对位异构体。邻、间、对位异构体有相似的极性和物理性质,因此,分离提纯较为困难。本篇文章中,报道了一种通过铜催化的脱氢/烯丙位羟化/氧化脱氢/芳构化串联过程,选择性合成间位羰基取代的苯酚和苯胺的方法(图1b)。由于羰基处于有机合成的枢纽,通过其进一步转化,几乎可以合成其它任何分子单元。本方法为间位取代酚类和苯胺提供了一种通用的合成路径。
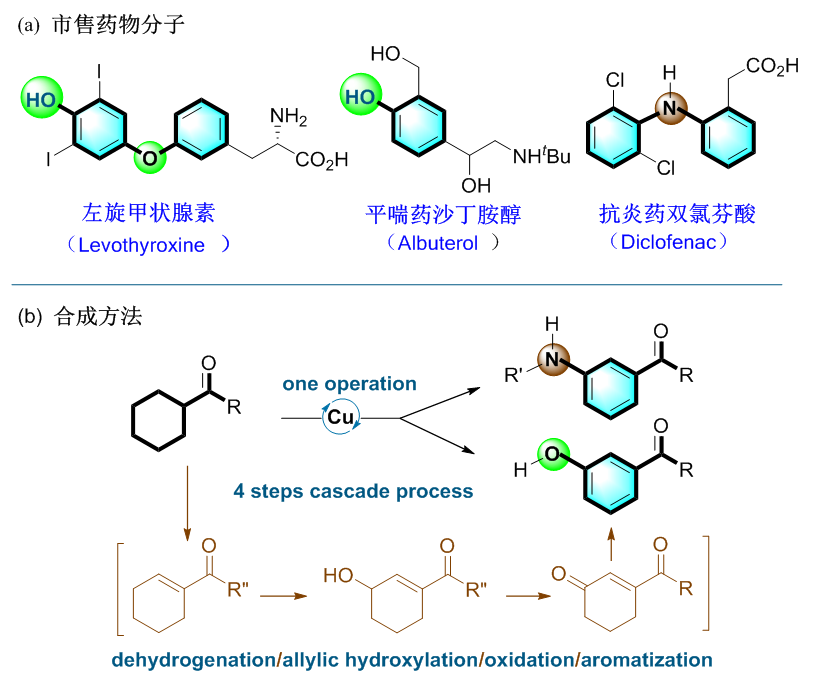
图1 铜催化脱氢一步合成间位羰基取代的苯酚和苯胺
我院博士研究生赵保印为文章的第一作者,王永强教授为通讯作者。
Bao-Yin Zhao, Qiong Jia, Yong-Qiang Wang*. Synthesis of meta-carbonyl phenols and anilines. Nature Communications. 2024, 15, 2415.
原文链接:https://www.nature.com/articles/s41467-024-46576-2